Бензальдегід

Бензальдегід (бензойний альдегід) С6Н5-СНО. Безбарвна рідина з запахом гіркого мигдалю (т. кип. 179,2 °С), утворюється під час гідролізу глікозиду амигдалину, що знаходиться у мигдалю, кісточках персиків, абрикосів. Бензальдегід розчинний у спирті, практично нерозчинний у воді. Бензальдегід можна отримувати каталітичним окисненням тулуолу, омиленням бензиліденхлориду чи з бензолу реакцією Гаттермана-Коха. На повітрі при бензальдегід легко окиснюється до бензойної кислоти.
Бензойний альдегід застосовується як ароматична речовина у парфумерії та харчовій промисловості та як сировина для отримання арилметанових барвників (наприклад, діамантового та малахітового зеленого).

Сфери застосування
Хімічний синтез
- прекурсор для отримання: коричного альдегіду, коричної кислоти, коричного спирту, бензойної кислоти, бензилового спирту, бензилбензоату, гідробензаміду; трифенілметанових барвників, зокрема малахітового зеленого; бензоїлборану, мигдалевої кислоти

Парфумерія
- бензальдегід створює мигдалеву ноту в ароматі
- синтез коричного спирту (стирон) – нота кориці; амілкоричного альдегіду (АСА) та гексилкоричного альдегіду (НСА) – нота жасмину; 3-метил-5-фенілпентан-1-олу (Mefrosol, Phenoxanol) - приємний свіжий запах білих квітів
Бджільництво
- бджолиний репелент – невеликими кількостями бензальдегіду обкурюють місця, від яких хочуть відігнати бджіл

Бензальдегід – аромат фруктів
Бензальдегід є однією з сполук, які надають характерний запах кістковим фруктам та ягодам. І, звичайно ж, мигдалю. Він міститься у персиках, абрикосах, сливах, черешнях та сливах, чорниці, журавлині. Незрілі плоди і листя бузини чорної містять глікозид самбунігрін, який розпадається на бензальдегід, глюкозу і синільну кислоту.
Смак та аромат алкогольних напоїв, отриманих настоюванням кісточок вишні, сливи, аличі та абрикосів теж у великій мірі залежить від бензальдегіду, який утворюється внаслідок ензиматичного розкладу амигдаліну у кісточках цих фруктів, потім переходить у м’якоть під час ферментації і врешті у дистилят у досить великій кількості.
Саме тому синтетичний чи натуральний (екстрагований з кісточок фруктів) бензальдегід використовують для створення парфумерних композицій. Але найбільше значення для парфумерного виробництва мають синтезовані з бензальдегіду сполуки.
Серед найбільш важливих похідних є:
- коричний спирт (стирон) – нота кориці
- амілкоричний альдегід (АСА) та гексилкоричний альдегід (НСА) – нагадують маслятисту базову ноту жасмину, хоча ці сполуки не містяться у ефірній олії жасмину. Більшість синтетичних жасминових парфумів використовують ці сполуки як основу для побудови аромату. Дуже часто використовуються у пральних порошках та кондиціонерах для одягу.
- 3-метил-5-фенілпентан-1-ол (Mefrosol, Phenoxanol) - приємний свіжий запах білих квітів

Хімічні властивості
Бензальдегід як ароматичний альдегід дає реакцію «срібного дзеркала», утворює ацеталі, ціангідридрини, гідросульфітні сполуки, альдоксими, гідразони, азометини.
Взаємодія з аміаком
Реагує з аміаком у співвідношенні 3:2 з утворенням гідробензаміду:

Утворений у процесі реакції імін бензальдегіду не здатен полімеризуватися, дві його молекули вступають у реакцію з третьою молекулою бензальдегіду.
Реакція Канніццаро
Була відкрита у 1853 році італійським вченим Станіслао Канніццаро. У присутності сильної основи чи концентрованого лугу бензальдегід, як і інші ароматичні альдегіди вступає у реакцію диспропорціонування. Одна молекула альдегіду окиснюється до бензойної кислоти, а інша – відновлюється до спирту:
![]()
Механізм реакції:

Реакції конденсації
Ароматичні альдегіди у присутності основ можуть вступати у реакції конденсації з альдегідами, кетонами, ангідридами карбонових кислот, з рухомими атомами водню при α-карбоновому атомі. Бензальдегід вступає у реакцію альдольної конденсації з оцтовим альдегідом. Альдольна конденсація двох різних карбонільних сполук називається перехресною альдольною конденсацією:


Утворений альдоль легко втрачає воду, перетворюючись у коричний альдегід.


Реакція Перкіна
Конденсація ангідридів карбонових кислот із бензальдегідом або іншими альдегідами, що не мають атомів гідрогену біля сусідніх із карбонілом груп, називають реакцією Перкіна (1868 р.). Конденсацію проводять у присутності основі основи: калієвої солі відповідної кислоти, карбонату калію або триетиламіну. Механізм реакції подібний до механізму кротонової конденсації. Завдяки такій взаємодії, після підкислення реакційної суміші виділяють α,β-ненасичені карбонові кислоти. Так, за взаємодії бензальдегіду з оцтовим ангідридом у присутності натрію чи калію ацетату утворюється корична кислота:
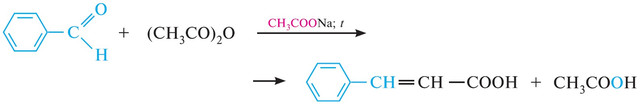
Механізм реакції:



Бензоїнова конденсація
Специфічною реакцією альдегідів ароматичного ряду є бензоїнова конденсація. Ця реакція полягає у конденсації двох молекул альдегіду у присутності солей синильної кислоти з утворенням ароматичних α-гідроксикетонів (бензоїнів, ацилоїнів):

Механізм бензоїнової конденсації:

Галогенування
При дії хлору на бензальдегід утворюється хлорангідрид бензойної кислоти:

Реакції електрофільного заміщення у бензольному ядрі
Для ароматичних альдегідів характерні реакції електрофільного заміщення за участі бензольного ядра (сульфування, нітрування і т.д.). Альдегідна група направляє замісник у м-положення:

Бензальдегід в органічному синтезі
Діамантовий зелений
Барвник амінотрифенілметанового ряду діамантовий зелений отримують конденсацією бензальдегіду з N,N-диетиланіліном у присутності кислотного каталізатора, найчастіше – концентрованої хлоридної кислоти. У результаті реакції утворюється безбарвна речовина, так звана лейкооснова діамантового зеленого [4,4’-біс-(диетиламіно)трифенілметан], яку потім окиснюють оксидом свинцю у кислому середовищі. При окисненні утворюється безбарвна речовина - карбінольна основа діамантового зеленого [4,4’-біс-(диетиламіно)трифенілкарбінол], яка з щавлевою кислотою дає сіль – барвник діамантовий зелений:


 або
або 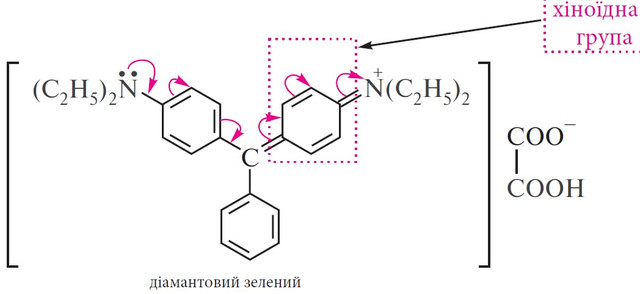
Бензиловий спирт

Реагенти:
бензальдегід – 19 мл
формалін – 40 мл
натрію гідроксиду 40 % водний розчин – 40 мл
натрію гідросульфіт
натрію сульфат (безводний)
Обладнання:
колба круглодонна двогорла з/ш 250 мл
воронка крапельна
холодильник зворотний із водяним охолодженням
мішалка магнітна
воронка ділильна
прилад для перегонки
У перехресній реакції Канніццаро за участі формальдегіду останній відіграє роль відновника, окиснюючись, відповідно, до форміатної кислоти. Це перетворення застосовують для відновлення ароматичних альдегідів до спиртів.
До суміші 19 мл бензальдегіду, 50 мл води та 40 мл формаліну у двогорлій колбі зі зворотним холодильником доливаємо за допомогою крапельної воронки при активному перемішуванні 40 мл 40 % розчину гідроксиду натрію. При цьому спостерігається значне розігрівання реакційної суміші (температура підвищується до 70 °С). Перемішування продовжуємо ще 30 хвилин, після чого реакційну суміш залишаємо на 10 год (можна залишити на ніч).
Поступово рідина розділяється на два шари. Верхній шар (бензиловий спирт) відділяємо за допомогою ділильної воронки. Відділений бензиловий спирт промиваємо у воронці перший раз – 20 мл насиченого розчину гідросульфіту натрію (для видалення залишку бензальдегіду, що не прореагував) і другий раз – 20 мл води. Промитий продукт із метою осушення витримуємо над безводним сульфатом натрію або сульфатом магнію, після чого переганяємо при атмосферному тиску, збираючи фракцію, яка кипить у межах 202-207 °С.
Отримуємо 13 г (64 %) продукту у вигляді безбарвної рідини з різким запахом. Чистий бензиловий спирт має температуру кипіння 205,5 °С, d=1,043, n=1,5396.
Дифенілметанол
(дифенілкарбінол, бензгідрол)

Реагенти:
бромобензен – 12,8 мл
магній (ошурки) – 3 г
бензальдегід – 10 мл
діетиловий етер, абсолютний – 85 мл
йод
кислота соляна (або хлорид амонію)
натрію бісульфіт
натрію карбонат
кальцію хлорид
петролейний етер або гексан
Обладнання:
колба круглодонна двогорла з/ш 500 мл
воронка крапельна
холодильник зворотний із водяним охолодженням (холодильник Дімрота)
мішалка магнітна
трубка хлоркальцієва
воронка ділильна
випарник ротаційний
колба Бунзена
воронка Бюхнера або фільтр Шота
Спирт, що утворюється внаслідок реакції, не здатен до дегідратації, тому стадія гідролізу не викликає значних труднощів.
У двогорлу колбу, оснащену крапельною воронкою та зворотним холодильником, закритим хлоркальцієвою трубкою, вміщуємо 3 г магнієвих ошурок і кілька кристаликів йоду. Готуємо розчин 19,0 г (12,8 мл) бромобензену у 50 мл абсолютного діетилового етеру. При активному перемішуванні із крапельної воронки швидко доливаємо 15 мл розчину бромобензену; щоб ініціювати реакцію колбу занурюємо у теплу воду. Залишок розчину бромобензену додаємо до реакційної суміші таким чином, щоб діетиловий етер повільно кипів; у випадку бурхливого протікання реакції колбу варто занурити у холодну воду.
Після додавання всієї кількості бромобензену підтримуємо температуру кипіння розчинника за допомогою нагрівання колби в бані з теплою водою до завершення реакції, ознакою чого є практично повне розчинення магнію.
Після завершення реакції утворення фенілмагнійброміду колбу охолоджуємо шляхом занурення у баню з льодяною водою; і при активному перемішуванні доливаємо із крапельної воронки (краплинами, але доволі швидко) розчин 10,6 г (10 мл) бензальдегіду в 15 мл абсолютного діетилового етеру. При додаванні бензальдегіду має спостерігатися розігрів суміші та кипіння розчинника; після додавання всієї кількості альдегіду для завершення реакції колбу слід кип’ятити ще 15 хвилин.
Охолоджуємо реакційну суміш; а потім – розкладаємо алкоголят магнію додаванням 20-30 г льоду. Унаслідок цього випадає осад основної солі магнію, який переводимо у розчин додаванням розчину соляної кислоти (суміш приблизно 10 мл концентрованої соляної кислоти та 10 мл води) або додаванням насиченого розчину хлориду амонію. Рідина розділяється на два шари: органічний (розчин продукту в етері) і водний.
Відділяємо органічний шар за допомогою ділильної воронки, водний шар додатково струшуємо у ділильній воронці з 20 мл діетилового етеру для повного вилучення продукту. Органічні витяжки об’єднуємо, промиваємо 5 мл 40 % розчину бісульфіту натрію (для видалення залишків бензальдегіду, який не прореагував). Після відділення бісульфітного розчину, органічний шар промиваємо насиченим розчином карбонату натрію, висушуємо над хлоридом кальцію. Унаслідок видалення діетилового етеру за допомогою ротаційного випарника отримуємо маслянистий залишок, який поступово застигає у кристалічну масу.
Після перекристалізації з неполярного розчинника (петролейний етер, гексан, лігроїн) отримуємо 10 г (54 %) продукту у вигляді крупних безбарвних кристалів з температурою плавлення 68 °С.
Етиловий естер 3-гідрокси-3-фенілпропіонової кислоти

Реагенти:
етилбромацетат – 13,9 мл
бензальдегід – 15,7 мл
цинковий пил – 10 г
бензен, абсолютний – 20 мл
бензен – 25 мл
діетиловий етер, абсолютний – 10 мл
сірчаної кислоти 10 % і 5 % водний розчин
натрію гідрокарбонат
магнію сульфат безводний
Обладнання:
колба круглодонна з/ш 500 мл
воронка крапельна
холодильник зворотний із водяним охолодженням (холодильник Дімрота)
мішалка магнітна
трубка хлоркальцієва
воронка ділильна
випарник ротаційний
прилад для перегонки при зниженому тиску
Відкрита у 1887 році реакція Реформадського дає можливість синтезувати естери β-гідроксикарбонових кислот із карбонільними сполуками у присутності цинку. Проміжна сполука, що утворюється внаслідок взаємодії цинку з α-галогенопохідною естеру, має будову швидше алкоголяту, а не цинкоорганічної сполуки, як це вважалося раніше.
У двогорлу колбу, оснащену крапельною воронкою та зворотним холодильником, закритим хлоркальцієвою трубкою вміщуємо 10 г цинкового пилу (можна застосовувати дрібні гранули цинку високої чистоти).
У крапельну воронку наливаємо розчин 13,9 мл етилового естеру бромоцтової кислоти та 15,7 мл свіжоперегнаного бензальдегіду в суміші 20 мл сухого бензену та 10 мл абсолютного діетилового етеру. До цинку додаємо 5-10 мл цього розчину та нагріваємо колбу до початку реакції. Після чого нагрівання вимикаємо, вмикаємо перемішування й додаємо суміші реагентів із крапельної воронки з такою швидкістю, щоб підтримувати слабке кипіння реакційної суміші (цей процес триватиме 0,5-1 год). Після додавання всього вмісту крапельної воронки, реакційну суміш слід кип’ятити ще впродовж 30 хв.
Після завершення реакції колбу охолоджуємо льодяною водою та при інтенсивному перемішуванні виливаємо реакційну суміш у 75 мл 10 % водного розчину сірчаної кислоти, охолодженої до 0 °С. (Охолодження необхідне, щоб уникнути небажаних побічних реакцій: гідролізу естерної групи до карбоксильної, а також дегідратації з утворенням похідної α,β-ненасиченої карбонової кислоти).
Органічний шар відділяємо за допомогою ділильної воронки; водний шар додатково екстрагуємо бензеном (двічі по 12 мл бензену). Об’єднані бензенові екстракти промиваємо охолодженим до 0 °С 5 % водним розчином сірчаної кислоти (двічі по 12 мл); один раз промиваємо 10 мл охолодженого насиченого розчину гідрокарбонату натрію; після чого промиваємо дистильованою водою (двічі по 10 мл). Щоб уникнути втрат продукту, рекомендується проекстрагувати кислі водні розчини діетиловим етером (двічі по 12 мл).
Об’єднуємо бензеновий та етерний розчин продукту, висушуємо 1,5-2 г безводного сульфату магнію. Розчинники відганяємо за допомогою ротаційного випарника, а залишок переганяємо при зниженому тиску, збираючи фракцію, що википає при 150-154 °С (10-12 мм рт.ст.), або 128-132 °С (5-7 мм рт.ст.).
Отримуємо 13-15 г (62-72 %) продукту у вигляді безбарвної маслянистої рідини.
- Хімія для роботи з чорними та кольоровими металамиРекомендації щодо проведення хімічної підготовки металів для подальшої роботи з нимиХімія для роботи з чорними та кольоровими металами
- Лимонна кислота: застосування у харчовій промисловості, побуті та інших сферахЛимонна кислота – універсальний інгредієнт, який широко використовується в харчовій промисловості, косметології, медицині та побуті. Дізнайтеся, як вона допомагає зберігати продукти, очищати поверхні та покращувати якість випічки. У цій статті ми розглянемо її основні властивості та ефективне застосування.Лимонна кислота: застосування у харчовій промисловості, побуті та інших сферах





